Pouvez-vous marcher facilement sur un kilomètre ? Cette simple question pourrait aider les médecins à détecter les patients qui ont le plus besoin de faire un bilan osseux.

Le vieillissement s'explique en partie par l’usure engendrée par des atomes et molécules réactives - les radicaux libres - qui sont à l’origine du « stress oxydatif ».On devrait pouvoir vivre plus longtemps en bonne santé en diminuant le niveau des radicaux libres, ou en les neutralisant. LaNutrition.fr fait le point sur ces composés toxiques et les moyens de les combattre.
La théorie du vieillissement par le stress oxydatif a été formulée en 1954 par le Pr Denham Harman (université du Nebraska). Elle stipule que le vieillissement – et les maladies associées - sont dus à l’usure engendrée par des atomes et molécules réactives, les radicaux libres. Ceux-ci sont à l’origine du « stress oxydatif ». Selon cette théorie, en diminuant le niveau des radicaux libres, ou en les neutralisant, il serait possible d’allonger la vie en bonne santé.
Les maladies dégénératives associées à l’âge sont connues : cancer, maladies cardiovasculaires, déclin du système immunitaire, démences et Parkinson, cataractes, ostéoporose. Ces maladies peuvent s’expliquer par le fait que les cellules somatiques dégénèrent, comme dans le cas du cancer.Le risque de cancer augmente dans la deuxième partie de la vie tant chez les espèces à durée de vie courte comme les rats, que chez les espèces qui vivent le plus longtemps, comme les hommes. Les taux de cancers sont élevés chez un rat de deux ans, mais faibles chez un enfant du même âge.L’un des facteurs les plus importants pour expliquer la longévité d’une espèce à l’autre, c’est le métabolisme de base (basal metabolic rate en anglais, BMR), c'est-à-dire la dépense énergétique au repos, rapportée au poids. Le BMR est sept fois plus élevé chez un rat que chez un homme. Le BMR peut certainement influencer le niveau de substances dangereuses, qui sont formées au cours du métabolisme des êtres vivants, notamment des substances oxydantes. Par exemple, chez les mammifères, il y a une relation assez nette entre le BMR d’une espèce et les dégâts oxydatifs que subit son ADN.
| Le stress oxydatif est impliqué dans les troubles liées à l’âge |
|
A ce jour plus de 100 troubles et maladies liés à l’âge ont été attribuées aux radicaux libres. Par exemple :
|
Les dégâts oxydatifs subis par l’ADN, mais aussi par les protéines et les graisses et par d’autres molécules, s’accumulent avec l’âge et expliquent en grande partie pourquoi les cellules, les tissus, les organes des personnes âgées sont plus abîmés que ceux des enfants.
Le métabolisme normal produit des substances oxydantes qu’on appelle radicaux libres. Ce sont notamment l’anion superoxyde (O2-), le peroxyde d’hydrogène (H2O2) et le radical hydroxyle (.OH). Il faut souligner que ces substances produites naturellement par l’organisme apparaissent aussi lorsqu’une personne est exposée au rayonnement radioactif, et qu’elles sont mutagènes, c’est-à-dire capables de provoquer un cancer.
Lorsque les graisses sont oxydées, elles donnent naissance à d’autres composés mutagènes comme les radicaux époxydes, hydropéroxydes, alkoxyles et péroxyles ainsi qu’à des aldéhydes particuliers appelés énals.
L‘oxygène singulet (1O2) est une forme très énergétique et mutagène de l’oxygène qui peut provenir du transfert d’énergie de la lumière, du métabolisme respiratoire des neutrophiles, ou de la péroxydation des graisses.
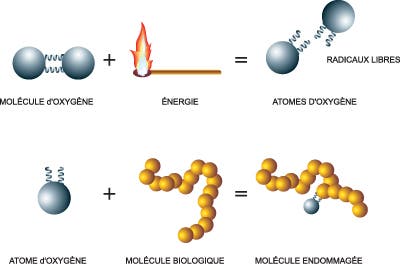
Pour se prémunir contre les dégâts provoqués par ces substances, les animaux ont de nombreuses défenses antioxydantes, mais comme celles-ci sont imparfaites, elles n’empêchent pas une petite partie de l’ADN de s’oxyder. Ces lésions sont réparées par des enzymes qui excisent la partie abîmée ; ces fragments d’ADN oxydés sont ensuite éliminés dans les urines. D’ailleurs, un des moyens d’évaluer les dégâts oxydatifs subis par l’ADN consiste à mesurer la quantité de ces morceaux abîmés dans l’urine. « Nous estimons, dit le Pr Bruce Ames (université de Californie, Berkeley) que l’ADN d’une cellule de rat est ainsi agressé en moyenne 100 000 fois chaque jour, et environ 10 000 fois chez l’homme. » Les enzymes spécialisées parviennent à réparer l’ADN, mais hélas pas complètement et les lésions s’accumulent avec l’âge si bien que chez le rat âgé (2 ans), on relève environ 2 millions de lésions par cellule, soit deux fois plus que chez le rat jeune.
| Des « ciseaux » spécialisés |
|
Témoin de l’importance des lésions oxydatives de l’ADN dans le cancer et le vieillissement, il existe des enzymes spécialisées, qu’on appelle glycosylases, dont le rôle est d’exciser ces lésions au niveau même de l’ADN. Les glycosylases peuvent être comparées à des « ciseaux » moléculaires qui ôtent les parties abîmées. Si l’on prend le cas de la 8-oxo-2’-déoxyguanosine, une lésion due à une attaque oxydative d’une base de l’ADN, la perte d’activité d’une glycosylase spécifique augmente le taux de mutation spontanées, ce qui montre bien que ces lésions oxydatives ont le pouvoir de déclencher des cancers. Que deviennent les lésions excisées ? Elles sont éliminées dans les urines où l’on peut les doser pour juger du niveau d’oxydation que subit l’ADN. Un organisme en bonne santé dispose heureusement d’autres outils moléculaires pour les remplacer « à neuf » dans l’ADN. |
Les mutations (qui peuvent être provoquées par ces lésions oxydatives) s’accumulent aussi avec l’âge. Par exemple, il y a dans les lymphocytes (globules blancs) des personnes âgées environ 9 fois plus de mutations que dans ceux des nouveaux-nés.
L’un des maillons faibles de l’organisme s’appelle mitochondrie. Les mitochondries sont de petites centrales énergétiques nichées au cœur de nos cellules. Elles disposent de leur propre ADN qu’on note ADNmt pour ADN mitochondrial. L’ADNmt d’une cellule de foie de rat est 10 fois plus endommagé que l’ADN de la cellule elle-même. Ceci s’explique par le fait que la mitochondrie est le siège des réactions qui produisent de l’énergie, mais aussi, comme toute centrale, des déchets énergétiques sous la forme de radicaux libres. Paradoxalement, la mitochondrie ne dispose pas de moyens de protection et de réparation très sophistiqués. Le problème, c’est que les radicaux libres produits dans la mitochondrie ont tendance à « fuir » dans le reste de la cellule. La cellule se défend contre ce bombardement en remplaçant en permanence ses mitochondries, mais elle ne peut pas empêcher les lésions oxydatives de s’accumuler dans l’ADN mitochondrial.
Les oxydants endommagent aussi les graisses de l’organisme ainsi que ses protéines. Plusieurs chercheurs ont montré que les enzymes qui « digèrent » les protéines ainsi abîmées sont dépassés par l’ampleur de la tâche : du coup, les protéines oxydées s’accumulent avec l’âge. On assiste d’ailleurs à cette accumulation de protéines oxydées chez les enfants et les personnes victimes de deux maladies du vieillissement prématuré : le syndrome de Werner et la progeria. Chez ces personnes, le taux de protéines oxydées est infiniment supérieur à la normale.
L’organisme est équipé de systèmes de protection anti-radicaux libres, qu’on appelle aussi antioxydants (tableau 1). Il puise aussi dans l’alimentation des molécules qui ont ce pouvoir (tableau 2).
|
Antioxydants de l’organisme |
Fonction |
|
Superoxyde dismutase (SOD) à base de zinc et cuivre |
Enzyme. Neutralise les radicaux superoxydes en les transformant en péroxyde d’hydrogène |
|
Superoxyde dismutase (SOD) à base de manganèse |
Enzyme. Neutralise les radicaux superoxydes en les transformant en péroxyde d’hydrogène |
|
Catalase (à base de fer) |
Enzyme. Neutralise les péroxydes d’hydrogène en les transformant en eau et oxygène |
|
Glutathion péroxydase (à base de sélénium) |
Enzyme. Neutralise les péroxydes d’hydrogène en les transformant en eau et oxygène |
|
Transferrine |
Protéine. Transporte le fer. |
|
Lactoferrine |
Protéine. Transporte le fer. |
|
Cerruloplasmine |
Protéine. Transporte le cuivre. |
|
Acide urique |
Neutralise les radicaux libres dans les compartiments extra-cellulaires. |
|
Albumine |
Protéine. Neutralise les radicaux libres. |
|
Glutathion |
Protéine. Neutralise les radicaux libres. Détoxifiant. |
|
Coenzyme Q10 |
Transporteur d’électrons. Prévient les réactions radicalaires dans les mitochondries. |
|
Mélatonine |
Hormone anti-oxydante. |
|
Antioxydants de l’alimentation |
Fonction |
|
Vitamine C (fruits, légumes) |
Réagit avec les radicaux libres dans le plasma (sang) et à l’intérieur des cellules. Régénère la vitamine E et le bêta-carotène. |
|
Vitamine E (germe de blé, noix, amandes, huiles végétales) |
Réagit avec les radicaux libres dans les milieux gras. Protège les membranes, les graisses circulantes, et les protéines. |
|
Caroténoïdes (légumes à feuilles vert sombre, carottes, tomates, maïs, brocolis, agrumes) |
Réagit avec les radicaux libres dans les milieux gras. Protège les membranes, les graisses circulantes, et les protéines. |
|
Polyphénols (fruits, légumes) |
Réagissent avec les radicaux libres dans les milieux aqueux et/ou gras. Protègent la vitamine C. |
|
Terpènes (épices, aromates) |
Neutralisent des radicaux libres. |
|
Sélénium, fer, zinc, manganèse, cuivre (viandes, végétaux). |
Composants des enzymes antioxydantes. |
|
Cystéine (viandes, végétaux) |
Précurseur du glutathion. |
|
Acide phytique (céréales complètes) |
Minimise la concentration des formes réactives des minéraux (fer, cuivre, manganèse) qui peuvent donner naissance à des radicaux libres. |
|
Sulforaphane (Légumes crucifères : brocoli, choux, choux de Bruxelles) |
Induit des enzymes détoxifiantes qui s’opposent à la formation du radical superoxyde. |
Ils ont plusieurs origines, aussi bien à l’intérieur de l’organisme qu’à l’extérieur.
D’abord, ils sont la conséquence de la respiration aérobique normale, qui est le mécanisme par lequel nous nous procurons de l’énergie : la mitochondrie consomme de l’oxygène, qu’elle réduit par étapes successives pour libérer en dernier lieu de l’eau. Les sous-produits inévitables de ce processus sont l’anion superoxyde (O2-), le peroxyde d’hydrogène (H2O2) et le radical hydroxyle (.OH). On estime qu’environ 1012 molécules d’oxygène sont utilisées chaque jour par une cellule de rat et que 2% « fuient » sous la forme de molécules d’oxygène partiellement réduites. Ceci représente 2x1010 molécules de superoxyde et de peroxyde d’hydrogène par cellule et par jour.
Autre source d’oxydants : la destruction par les cellules du système immunitaire de cellules infectées par des bactéries et des virus. Les phagocytes utilisent pour cela des oxydants redoutables comme le monoxyde d’azote (NO), l’anion superoxyde, le peroxyde d’hydrogène et l’ion hypochlorite (OCl-). Les infections chroniques entraînent une activité des phagocytes elle aussi chronique, ce qui conduit à l’inflammation et aux risques qui lui sont associés (dont le cancer).
Les péroxysomes sont des organelles qui ont pour rôle de dégrader les acides gras et d’autres molécules. Ils fabriquent des sous-produits sous la forme de x, qui est ensuite pris en charge par une enzyme antioxydante, la catalase. Mais on pense qu’une partie des péroxydes d’hydrogène échappe à ce processus, ce qui ajoute encore au fardeau oxydant sur la cellule.
Mentionnons pour conclure les enzymes de la famille Cytochrome P450, ou enzymes de phase 1, qui constituent l’une des premières lignes de défense chez tous les animaux pour se protéger des substances toxiques de plantes. Ces enzymes sont également sollicités pour prendre en charge des substances chimiques (médicaments, pesticides…). Leur activité génère des sous-produits oxydatifs qui peuvent endommager l’ADN.
A ces sources d’oxydants internes viennent s’ajouter les oxydants issus de notre environnement, à commencer par les oxydes d’azote dans la fumée de cigarette ou la pollution atmosphérique, qui oxydent des molécules de l’organisme. Conséquence : ils mobilisent nos défenses antioxydantes et épuisent nos réserves de vitamine C ou de vitamine E. Voici l’une des raisons pour lesquelles les fumeurs sont souvent carencés en vitamine C (et très mal protégés contre le vieillissement accéléré et les cancers).
Les sels de fer et de cuivre en excès favorisent les radicaux libres par une réaction dite de Fenton. Les personnes qui, par suite d’un défaut génétique, souffrent d’hémochromatose ont un risque plus élevé que les autres de cancers et de maladies cardiovasculaires. Elles doivent recourir à des saignées pour éliminer l’excès de fer.
Les rayons UV du soleil sont à l’origine de l’apparition dans le corps de l’oxygène singulet et d’autres espèces réactives de l’oxygène.
Il existe plusieurs preuves que le stress oxydant est impliqué dans le vieillissement humain. Nous n’en citerons que quelques-unes, emblématiques.
La théorie du vieillissement par le stress oxydatif est aujourd’hui acceptée par la majorité des chercheurs, même si elle ne constitue pas la seule explication au vieillissement humain. Lire à ce sujet les autres théories du veillissement : Le gène égoïste, La théorie du soma jetable, Le stress fait-il vieillir ?
Antioxydants conseillés : glutathion de Vital+, antioxydant 200 de Synergia
Lectures conseillées : Arrêtons de vieillir de Pierre Boutron, La diététique anti-âge d'Elyane Lèbre
(1) Taub, J. : A cytosolic catalase is needed to extend adult lifespan in C. elegans daf-C and clk-1 mutants. Nature, 1999, 399 : 162-166.
(2) Lee, C.K. : Gene expression of aging and its retardation by caloric restriction. Science, 1999, 285(5432) : 1390-1393.
(3) Migliaccio, E. : The p66shc adaptor protein controls oxidative stress response and life span in mammals. Nature, 1999, 402 : 309-313.
(4) Melov, S. : Extension of Life-Span with Superoxide Dismutase/Catalase Mimetics. Science, 2000: 1567-1569.
Les meilleurs livres et compléments alimentaires sélectionnés pour vous par NUTRISTORE, la boutique de la nutrition.
Découvrir la boutique





Pouvez-vous marcher facilement sur un kilomètre ? Cette simple question pourrait aider les médecins à détecter les patients qui ont le plus besoin de faire un bilan osseux.

Un régime mensuel mimant les effets du jeûne améliore l'immunité, diminue la graisse du foie et "rajeunit" l'âge biologique.

Des découvertes récentes révolutionnent notre compréhension du fonctionnement du cerveau et permettent de mettre en place des stratégies pour préserver ou restaurer ses fonctions cognitives.