Aussi connue sous le terme d’« hormone du sommeil », la mélatonine est une molécule naturellement produite par l’organisme. Des études suggèrent qu’elle pourrait jouer un rôle dans la prévention et le traitement du cancer.

Depuis plusieurs années, deux courants de pensée s’affrontent pour expliquer comment une cellule normale devient cancéreuse, avec d’un côté les partisans d’une origine génétique et de l’autre ceux qui évoquent une piste métabolique. Éclairage.
Dans les tumeurs, les cellules cancéreuses prolifèrent de manière incontrôlée : elles grossissent, se divisent indéfiniment, et, au fil du temps, peuvent quitter le site de la tumeur et métastaser. Tous les scientifiques s’accordent pour dire que le cancer naît de la dérégulation du cycle cellulaire. Mais comment expliquer ce comportement « incohérent » des cellules ?
Longtemps, la piste génétique a été privilégiée. Aujourd’hui, plusieurs chercheurs avancent une autre piste : celle du cancer « maladie métabolique », comme peut l’être le diabète. Si le cancer est d’origine métabolique, alors les traitements devraient cibler les mitochondries. Dans son nouveau livre Les clés du cancer, Laurent Schwartz décrit plusieurs pistes de traitement métabolique du cancer.
Enseignée depuis des décennies aux étudiants en biologie et en médecine, la « théorie des mutations somatiques » est celle qui est la plus communément admise. Cette hypothèse s’appuie notamment sur l’observation des prédispositions génétiques des individus au cancer : dans certaines familles, les cancers sont plus fréquents que dans d’autres. Par exemple, des mutations des gènes BRCA1 et BRCA2 augmentent le risque de cancer du sein et de l’ovaire chez la femme. Ces deux gènes font partie de la famille des gènes « suppresseurs de tumeurs ».
Selon cette théorie, ce sont des mutations somatiques, c’est-à-dire qui ne touchent pas les cellules reproductrices de la lignée germinale, qui sont à l’origine des tumeurs.
Le cycle de la cellule
Habituellement, dans notre organisme, la cellule traverse plusieurs phases au cours d’un cycle :
- phase G1 : croissance et préparation de la synthèse d’ADN ;
- phase S : synthèse de l’ADN ;
- phase G2 : croissance et préparation de la mitose (M) ;
- phase M : division de la cellule en deux cellules-filles.
Ces phases sont contrôlées par des gènes, comme les kinases cycline-dépendantes, les Cdk. Des mutations touchant les gènes qui contrôlent le cycle cellulaire peuvent aboutir à une dérégulation du rythme auquel la cellule se divise.
On distingue deux grandes famille de gènes dont les mutations peuvent favoriser la cancérisation des cellules :
D’après la théorie des mutations somatiques, le cancer est une maladie génétique complexe qui résulte de mutations héréditaires (BRCA1…) ou aléatoires dans des proto-oncogènes (ras…) ou dans des gènes suppresseurs de tumeurs (p53...).
Mais plusieurs incohérences subsistent dans cette théorie, comme l’expliquent Thomas Seyfreid (Boston College) et Christos Chinopoulos (université Semmelweis de Budapest) dans un article paru dans la revue Metabolites :
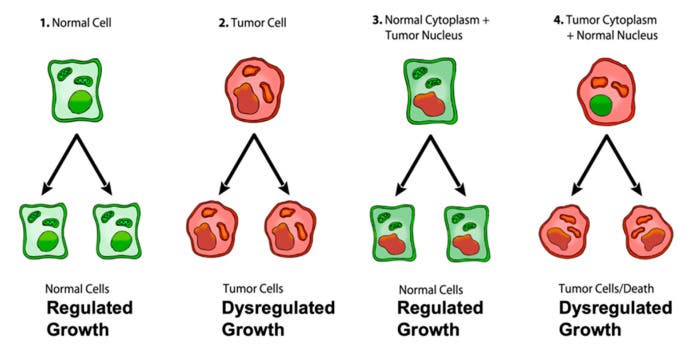
Expériences de transfert de noyau. En vert : cellule normale. En rouge : cellule tumorale. D'après Seyfried et Chinopoulos (Metabolites 2021)
C’est pourquoi des scientifiques de divers horizons proposent une autre théorie, basée sur la perturbation du métabolisme : la théorie métabolique mitochondriale.
Cette hypothèse alternative soutient que le cancer naît d’un dysfonctionnement de la mitochondrie, l’usine énergétique de la cellule. Habituellement, les cellules utilisent le glucose pour fabriquer de l’ATP dans la mitochondrie : c’est la respiration cellulaire, qui pour une molécule de glucose fournit 36 molécules d’ATP. Mais dans les cellules cancéreuses, la respiration cellulaire est défectueuse.
Cette hypothèse trouve ses origines dans les années 1920 quand Otto Warburg, prix Nobel de physiologie et de médecine, a observé que les cellules cancéreuses fermentent. Or la fermentation du sucre, qui se réalise sans oxygène, produit beaucoup moins d’ATP que la respiration cellulaire : seulement deux molécules pour une molécule de glucose.
Pour les scientifiques qui soutiennent la théorie métabolique mitochondriale, celle-ci est la seule à pouvoir expliquer « le paradoxe oncogénique » : le fait qu’une multitude de facteurs (amiante, virus oncogènes, radiations, vieillissement, inflammation…) aboutissent tous à la même conséquence, la cancérisation des cellules.
Toutes ces perturbations auraient pour point commun de gêner la respiration cellulaire et d’augmenter le stress oxydatif. L’excès d’espèces réactives de l’oxygène crée des dommages aux lipides, aux protéines et aux acides nucléiques.
Beaucoup de cellules qui ne peuvent plus respirer correctement vont mourir. Les tumeurs pourraient donc provenir des cellules qui, dans ce contexte, sont capables d’augmenter leur fermentation pour compenser les défaillances de leur respiration mitochondriale.
Pour Thomas Seyfreid et Christos Chinopoulos, « La plupart des cellules tumorales, quelle que soit leur origine tissulaire ou leurs anomalies génomiques, dépendent largement du métabolisme de la fermentation par les voies de la glycolyse et de la glutaminolyse pour la synthèse des métabolites de croissance et de l'ATP. Aucune cellule tumorale ne peut croître ou survivre sans métabolites ni énergie. Le ciblage simultané de ces voies offre une stratégie thérapeutique non toxique pour gérer efficacement la plupart des cancers. La stratégie la plus simple et la plus parcimonieuse pour gérer le cancer dans le cadre de la théorie métabolique mitochondriale consiste à restreindre la disponibilité du glucose et de la glutamine tout en plaçant tout le corps dans un état de cétose nutritionnelle. »
C’est pour ces raisons que, pour affamer les cellules cancéreuses en glucose, certains patients se tournent vers le régime cétogène : les corps cétoniques deviennent le carburant des cellules. Cependant, si des patients signalent une amélioration de leur bien-être, des cellules cancéreuses peuvent aussi utiliser les corps cétoniques. Le régime cétogène ne guérit pas la maladie. D’autres traitements sont nécessaires afin d’attaquer le cancer sur différents fronts.
Si le cancer est d’origine métabolique, alors les traitements devraient cibler les mitochondries. Dans son nouveau livre Les clés du cancer, Laurent Schwartz avance plusieurs pistes dans ce sens.
L’objectif de ces nouveaux traitements consiste à relancer la machinerie mitochondriale. Plusieurs molécules déjà bien connues des scientifiques pourraient avoir le potentiel de rétablir un métabolisme normal des cellules : le bleu de méthylène, l’acide lipoïque en association avec l’hydroxycitrate… Le bleu de méthylène est un colorant utilisé au laboratoire de biologie pour colorer les cellules. C’est aussi un antiseptique, un agent anti-paludéen et il induit l’apoptose des cellules cancéreuses.
Pour Laurent Schwartz, « Ces anciennes molécules sont potentiellement très efficaces contre le cancer ; c’est ce que nous montrent les essais faits sur les cellules et les souris. »
Les meilleurs livres et compléments alimentaires sélectionnés pour vous par NUTRISTORE, la boutique de la nutrition.
Découvrir la boutique





Aussi connue sous le terme d’« hormone du sommeil », la mélatonine est une molécule naturellement produite par l’organisme. Des études suggèrent qu’elle pourrait jouer un rôle dans la prévention et le traitement du cancer.
La vitamine C administrée en intraveineuse pourrait améliorer l’efficacité des traitements et la qualité de vie des patients. Mais des études doivent préciser quels sont ceux les plus à même d’en bénéficier.
Dans Affamer le cancer, Jane McLelland préconise une approche multidimensionnelle du cancer, qui doit être attaqué non seulement avec les traitements classiques, mais aussi des médicaments courants, "repositionnés". Explications.